NCERT Solutions for Class 12 Chemistry Chapter 13 Amines are crafted by our experienced and esteemed educators at Adda247. They emphasize understanding these Class 12 questions in the NCERT textbook, so make sure to revise the theory of Chapter 13 Amines before attempting the NCERT questions. To help students, we have provided theory part here too. Our Adda247 team have created the NCERT Solutions for other chapters for class 12 chemistry too.
NCERT Solutions for Class 12 Chemistry Chapter 13 Amines
Amines are derivative of ammonia obtained by the replacement of hydrogen. In the class 12 NCERT Solutions for this chapter, students will be able to understand the nomenclature, properties and structure of Amines. Amines are the most important nitrogen – containing organic compounds. Solved examples based on the basicity of amines, synthesis and reactions undergone by amines are well explained.
Subtopics of Class 12 Chemistry Chapter – 13 – Amines
- Structures of Amines
- Classification
- Nomenclature
- Preparation of Amines.
- Chemical reactions
- Methods of Preparation of Diazonium Salts
- Physical Properties
- Chemical reactions
- Importance of Diazonium salts in Synthesis of Aromatic Compounds.
Amines are formed by the replacement of hydrogen atom. Based on the number of hydrogen atoms replaced, amines are classified into three category: Primary, Secondary and Tertiary amines.
Primary amines are formed when one hydrogen atom of ammonia is replaced by R or Ar. Secondary amines are formed when two hydrogen atoms of ammonia or one hydrogen atom of R-NH2 are replaced by alkyl or aryl group. When all the three hydrogen atoms of NH3 are replaced by alkyl or aryl group it is called a tertiary amine. This was a brief about the chapter according to the latest CBSE syllabus.
NCERT Solutions Chemistry Class 12 Chapter 13
Q) Write the IUPAC names of the following compounds and classify them into primary, secondary and tertiary amines.
- (CH3)2CHNH2
- CH3(CH2)NH2
- CH3NHCH(CH3)2
- (CH3)3CNH2
- C6H5NHCH3
- (CH3CH2)2NCH3
- m-BrC6H4NH2
Answer:
- 1 – Methylethanamine (10amine)
- Propan – 1 – amine (10amine)
- N – Methyl – 2 – methyl ethanamine (20amine)
- 2 – Methylpropan – 2- amine (10amine)
- N – Methyl benzamine or N – methylaniline (20amine)
- N – Ethyl – N – methyl ethanamine (30amine)
- 3 – Bromobenzenamine or 3 – bromoaniline (10amine)
Q) Give one chemical test to distinguish between the following pairs of compounds.
- Methylamine and dimethylamine
- Secondary and tertiary amines
- Ethylamine and aniline
- Aniline and benzylamine
- Aniline and N-methylaniline.
Answer:
(i) Methylamine and dimethylamine :
Carbylamine test.
Methyl amine, on heating with alc. KOH solution and chloroform forms foul smelling methyl isocyanide. This test is not given by dimethylamine.
(ii) Secondary and tertiary amines :
Secondaty amines give libermann nitrosoamine test.
On heating with nitrous acid (prepared in situ), they give yellow coloured oily N-nitrosoamine.
Tertiary amines do not give such test.
(iii) Ethylamine and aniline :
Azo dye test.
Aniline on diazotization ( ice cold nitrous acid solution) followed by coupling with 2-naphtol (in alkaline solution) forms brilliant orange or red dye. Ethylamine will not form dye. It will give brisk effervescence (due to liberation of nitrogen gas) but solution remains clear.
(iv) Aniline and benzylamine :
Azo dye test.
Aniline on diazotization ( ice cold nitrous acid solution) followed by coupling with 2-naphtol (in alkaline solution) forms brilliant orange or red dye. Benzylamine will not give such test.
(v) Aniline and N-methylaniline :
Carbylamine test.
Aniline, on heating with alc. KOH solution and chloroform forms foul smelling methyl isocyanide. This test is not given by N-methylaniline.
Q) Account for the following :
- pKb of aniline is more than that of methylamine.
- Ethylamine is soluble in water whereas aniline is not.
- Methylamine in water reacts with ferric chloride to precipitate hydrated ferric oxide.
- Although amino group is o- and p- directing in aromatic electrophilic substitution reactions, aniline on nitration gives a substantial amount of m – nitroaniline.
- Aniline does not undergo Friedel – Crafts reaction.
- Diazonium salts of aromatic amines are more stable than those of aliphatic amines.
- Gabriel phthalimide synthesis is preferred for synthesising primary amines.
Answer:
i.) pKb of methylamine is lesser than that of aniline:
Aniline undergoes resonance and as a result, the electrons on the N-atom are delocalized over the benzene ring. Therefore, the electrons on the N-atom are less available to donate.
On the other hand, in case of methylamine (due to the +I effect of methyl group), the electron density on the N-atom is increased. As a result, aniline is less basic than methylamine. Thus, pKb of aniline is more than that of methylamine.
(ii) Ethylamine is soluble in water whereas aniline is not:
Ethylamine when added to water forms intermolecular H – bonds with water. Hence, it is soluble in water.
But aniline does not undergo H – bonding with water to a very large extent due to the presence of a large hydrophobic – C6H5 group. Hence, aniline is insoluble in water.
(iii) Methylamine in water reacts with ferric chloride to precipitate hydrated ferric oxide:
Due to the +I effect of – CH3 group, methylamine is more basic than water. Therefore, in water, methylamine produces OH – ions by accepting H+ ions from water.
CH3 – NH2 + H-OH à CH3 – NH3+ + OH-
Ferric chloride (FeCl3) dissociates in water to form Fe3+ and Cl – ions.
FeCl3 à Fe3+ + 3Cl-
Then, OH – ion reacts with Fe3+ ion to form a precipitate of hydrated ferric oxide.
2Fe3+ + 6OH- à Fe3O3 + 3H2O
(iv) Although amino group is o,p – directing in aromatic electrophilic substitution reactions, aniline on nitration gives a substantial amount of m-nitroaniline:
Nitration is carried out in an acidic medium. In an acidic medium, aniline is protonated to give anilinium ion (which is meta-directing).
For this reason, aniline on nitration gives a substantial amount of m-nitroaniline.
(v) Aniline does not undergo Friedel-Crafts reaction:
A Friedel-Crafts reaction is carried out in the presence of AlCl3. But AlCl3 is acidic in nature, while aniline is a strong base. Thus, aniline reacts with AlCl3 to form a salt.
Due to the positive charge on the N-atom, electrophilic substitution in the benzene ring is deactivated. Hence, aniline does not undergo the Friedel-Crafts reaction.
(vi) Diazonium salts of aromatic amines are more stable than those of aliphatic amines:
This resonance accounts for the stability of the diazonium ion. Hence, diazonium salts of aromatic amines are more stable than those of aliphatic amines.
(vii) Gabriel phthalimide synthesis is preferred for synthesising primary amines:
Gabriel phthalimide synthesis results in the formation of 1° amine only. 2° or 3° amines are not formed in this synthesis. Thus, a pure 1° amine can be obtained. Therefore, Gabriel phthalimide synthesis is preferred for synthesizing primary amines.
Q) Arrange the following :
i) In decreasing order of the pKb values:
CH2NH2, C6H5NHCH3, (C2H5)2NH,and C6H5NH2
ii) In increasing order of basic strength :
C6H5NH2, C6H5N(CH3)2, (C2H5)2NH and CH3NH2
(iii) In increasing order of basic strength :
- (a) Aniline, p-nitroaniline and p-toluidine.
- (b) C6H5NH2, C6H5NHCH3, C6H5CH2NH2.
(iv) In decreasing order of basic strength in gas phase:
C2H5NH2, (C2H5)2NH, (C2H5)3N and NH3
(v) In increasing order of boiling point:
C2H5OH, (CH3)2NH, C2H5NH2
(vi) In increasing order of solubility in water:
C6H5NH2, (C2H5)2NH, C2H5NH2.
Answer:
(i) In C2H5NH2, only one -C2H5 group is present while in (C2H5)2NH, two -C2H5 groups are present. Thus, the +I effect is more in (C2H5)2NH than in C2H5NH2. Therefore, the electron density over the N-atom is more in (C2H5)2NH than in C2H5NH2. Hence, (C2H5)2NH is more basic than C2H5NH2.
Also, both C6H5NHCH3 and C6H5NH2 are less basic than (C2H5)2NH and C2H5NH2 due to the delocalization of the lone pair in the former two. Further, among C6H5NHCH3 and C6H5NH2, the former will be more basic due to the +T effect of -CH3 group. Hence, the order of increasing basicity of the given compounds is as follows:
C6H5NH2 < C6H5NHCH3 < C2H5NH2 < (C2H5)2NH
We know that the higher the basic strength, the lower is the pKb values.
C6H5NH2 > C6H5NHCH3 > C2H5NH2 > (C2H5)2NH
(ii) C6H5N(CH3)2 is more basic than C6H5NH2 due to the presence of the +I effect of two -CH3 groups in C6H5N(CH3)2. Further, CH3NH2 contains one -CH3 group while (C2H5)2NH contains two -C2H5 groups. Thus, (C2H5)2 NH is more basic than C2H5NH2.
Now, C6H5N(CH3)2 is less basic than CH3NH2 because of the-R effect of -C6H5 group.
Hence, the increasing order of the basic strengths of the given compounds is as follows:
C6H5NH2 < C6H5N(CH3)2 < CH3NH2 < (C2H5)2N
(iii)
a.)In p-toluidine, the presence of electron-donating -CH3 group increases the electron density on the N-atom. Thus, p-toluidine is more basic than aniline.
On the other hand, the presence of electron-withdrawing -NO2 group decreases the electron density over the N-atom in p-nitroaniline. Thus, p-nitroaniline is less basic than aniline.Hence, the increasing order of the basic strengths of the given compounds is as follows:
p-Nitroaniline < Aniline < p-Toluidine
(b) C6H5NHCH3 is more basic than C6H5NH2 due to the presence of electron-donating -CH3 group in C6H5NHCH3. Again, in C6H5NHCH3, -C6H5 group is directly attached to the N-atom. However, it is not so in C6H5CH2NH2. Thus, in C6H5NHCH3, the -R effect of -C6H5 group decreases the electron density over the N-atom. Therefore, C6H5CH2NH2 is more basic than C6H5NHCH3.
Hence, the increasing order of the basic strengths of the given compounds is as follows:
C6H5NH2 < C6H5NHCH3 < C6H5CH2NH2.
(iv) In the gas phase, there is no solvation effect. As a result, the basic strength mainly depends upon the +I effect. The higher the +I effect, the stronger is the base. Also, the greater the number of alkyl groups, the higher is the +I effect. Therefore, the given compounds can be arranged in the decreasing order of their basic strengths in the gas phase as follows:
(C2H5)3N > (C2H5)2NH > C2H5NH2 > NH3
(v) The boiling points of compounds depend on the extent of H-bonding present in that compound. The more extensive the H-bonding in the compound, the higher is the boiling point. (CH3)2NH contains only one H-atom whereas C2H5NH2 contains two H-atoms. Then, C2H5NH2 undergoes more extensive H-bonding than (CH3)2NH. Hence, the boiling point of C2H5NH2 is higher than that of (CH3)2NH.
Further, O is more electronegative than N. Thus, C2H5OH forms stronger H-bonds than C2H5NH2. As a result, the boiling point of C2H5OH is higher than that of C2H5NH2 and (CH3)2NH.
Now, the given compounds can be arranged in the increasing order of their boiling points as follows
(CH3)2NH < C2H5NH2 < C2H5OH
(vi) The more extensive the H-bonding, the higher is the solubility. C2H5NH2 contains two H-atoms whereas (C2H5)2NH contains only one H-atom. Thus, C2H5NH2 undergoes more extensive H-bonding than (C2H5)2NH. Hence, the solubility in water of C2H5NH2 is more than that of (C2H5)2NH.
Further, the solubility of amines decreases with increase in the molecular mass. This is because the molecular mass of amines increases with an increase in the size of the hydrophobic part. The molecular mass of C6H5NH2 is greater than that of C2H5NH2 and (C2H5)2NH.Hence, the increasing order of their solubility in water is as follows:
C6H5NH2 < (C2H5)2NH < C2H5NH2
Q) Describe a method for the identification of primary, secondary and tertiary amines.
Answer: Primary, secondary and tertiary amines can be identified and distinguished by Hinsberg’s test. In this test, the amines are allowed to react with Hinsberg’s reagent, benzenesulphonyl chloride (C6H5SO2Cl). The three types of amines react differently with Hinsberg’s reagent. Therefore, they can be easily identified using Hinsberg’s reagent.
Primary amines react with benzenesulphonyl chloride to form N-alkylbenzenesulphonyl amide which is soluble in alkali.
Due to the presence of a strong electron-withdrawing sulphonyl group in the sulphonamide, the H-atom attached to nitrogen can be easily released as proton. So, it is acidic and dissolves in alkali.
Secondary amines react with Hinsberg’s reagent to give a sulphonamide which is insoluble in alkali. There is no H-atom attached to the N-atom in the sulphonamide. Therefore, it is not acidic and insoluble in alkali. On the other hand, tertiary amines do not react with Hinsberg’s reagent at all.
Q) Write short notes on the following :
(i) Carbylamine reaction
(ii) Diazotisation
(iii) Hofmann’s bromamide reaction
(iv) Coupling reaction
(v) Ammonolysis
(vi) Acetylation
(vii) Gabriel phthalimide synthesis
Answer:
(i) Carbylamine reaction
Carbylamine reaction is used as a test for the identification of primary amines. When aliphatic and aromatic primary amines are heated with chloroform and ethanolic potassium hydroxide, carbylamines (or isocyanides) are formed. These carbylamines have very unpleasant odours. Secondary and tertiary amines do not respond to this test.
(ii) Diazotisation
Aromatic primary amines react with nitrous acid (prepared in situ from NaNO2and a mineral acid such as HCl) at low temperatures (273-278 K) to form diazonium salts. This conversion of aromatic primary amines into diazonium salts is known as diazotization.
For example, on treatment with NaNO2and HCl at 273 – 278 K, aniline produces benzenediazonium chloride, with NaCl and H2O as by-products.
(iii) Hoffmann bromamide reaction
When an amide is treated with bromine in an aqueous or ethanolic solution of sodium hydroxide, a primary amine with one carbon atom less than the original amide is produced. This degradation reaction is known as Hoffmann bromamide reaction. This reaction involves the migration of an alkyl or aryl group from the carbonyl carbon atom of the amide to the nitrogen atom.
(iv) Coupling reaction
The reaction of joining two aromatic rings through the – N=N – bond is known as coupling reaction. Arenediazonium salts such as benzene diazonium salts react with phenol or aromatic amines to form coloured azo compounds.
It can be observed that, the para-positions of phenol and aniline are coupled with the diazonium salt. This reaction proceeds through electrophilic substitution.
(v) Ammonolysis
When an alkyl or benzyl halide is allowed to react with an ethanolic solution of ammonia, it undergoes nucleophilic substitution reaction in which the halogen atom is replaced by an amino ( – NH2) group. This process of cleavage of the carbon-halogen bond is known as ammonolysis.
When this substituted ammonium salt is treated with a strong base such as sodium hydroxide, amine is obtained. Though primary amine is produced as the major product, this process produces a mixture of primary, secondary and tertiary amines, and also a quaternary ammonium salt as shown.
(vi) Acetylation
Acetylation (or ethanoylation) is the process of introducing an acetyl group into a molecule. Aliphatic and aromatic primary and secondary amines undergo acetylation reaction by nucleophilic substitution when treated with acid chlorides, anhydrides or esters. This reaction involves the replacement of the hydrogen atom of – NH2or > NH group by the acetyl group, which in turn leads to the production of amides.
To shift the equilibrium to the right hand side, the HCl formed during the reaction is removed as soon as it is formed. This reaction is carried out in the presence of a base (such as pyridine) which is stronger than the amine. When amines react with benzoyl chloride, the reaction is also known as benzoylation.
(vii) Gabriel phthalimide synthesis
Gabriel phthalimide synthesis is a very useful method for the preparation of aliphatic primary amines. It involves the treatment of phthalimide with ethanolic potassium hydroxide to form potassium salt of phthalimide. This salt is further heated with alkyl halide, followed by alkaline hydrolysis to yield the corresponding primary amine.
Q) Give the structures of A, B and C in the following reactions :
i.) CH3CH2I NaCN A OH Partial hydrolysis B NaOH + Br2 C
ii.) C6H5N2 CuCN A H2O/H+ B NH3heat C
iii.) CH3CH2Br KCN A LiAlH4 B HNO2 00 C C
iv.) C6H5NO2 Fe/HCl A NaNO2 + HCl273K B H2O/H+Heat C
v.) CH3COOH NH3heat A NaOBr B NaNO2/HCl C
vi.) C6H5NO2 Fe/HCl A HNO2 273K B C6H5OH C
Answer:
i.) CH3CH2I NaCN CH3CH2CN OH-Partial pressure CH3CH2C=ONH2 NaOH + Br2 CH3CH2NH2
ii.) C6H5N2Cl CuCN C6H5CN H2O/H+ C6H5COOH NH3 Heat C6H5CONH2
iii.) CH3CH2Br KCN CH3CH2CN LiAlH4 CH3CH2CH2NH2 HNO2 0C CH3CH2CH2OH
iv.) C6H5NO2 Fe/HCl C6H5NH2 NaNO2 + HCl 273 K C6H5-N2Cl H2O/H+ heat C6H5OH
v.) CH3COOH NH3heat CH3CONH2 NaOBr CH3NH2 NaNO2/HCl CH3OH
vi.) C6H5NO2 Fe/HCl C6H5NH2 HNO2 273K C6H5-N2CL C6H5OH p-Hydroxyaazobenzene
Q) Complete the following reactions :
(i) C6H5NH2 + CHCl3 + alc. KOH à
(ii) C6H5N2Cl + H3PO2 + H2O à
(iii) C6H5NH2 + H2SO4(conc) ->
(iv) C6H5N2Cl + C2H5OH à
(v) C6H5NH2 + Br2(aq) ->
(vi) C6H5NH2 + (CH3CO) 2 à
(vii) C6H5N2Cl + HBF4 NaNO3/Cu
Answer:
i.) C6H5NH2 + CHCl3 + alc. KOH à 3H2O +3KCl + C6H5 – NC
ii.) C6H5N2Cl + H3PO2 + H2O à C6H6 + N2 + H3PO3 + HCl
iii.) C6H5NH2 + conc. H2SO4 à C6H5NH2+HSO4-
iv.) C6H5N2Cl + C2H5OH à C6H6 + CH3CHO + N2 + HCl
v.) C6H5NH2 + Br2(aq) à 2,4,6-Tribromoaniline + 3HBr
vi.) C6H5NH2 + (CH3CO)2O à C6H5 – NH – C=O – CH3 + CH3COOH
vii.) C6H5N2Cl + C2H5OH + HBF4 NaNO2/Cu heat C6H5NO2 + N2 + NaBF4
Q) Why cannot aromatic primary amines be prepared by Gabriel phthalimide synthesis?
Answer: During Gabriel phthalimide synthesis, the reaction between phthalimide and ethanolic potassium hydroxide gives potassium salt of phthalimide.
The salt on heating with alkyl halide followed by alkaline hydrolysis gives corresponding primary amine.
Aromatic primary amines cannot be prepared by Gabriel phthalimide synthesis as aryl halides do not undergo nucleophilic substitution with the salt formed by phthalimide.
Q) Give plausible explanation for each of the following :
(i) Why are amines less acidic than alcohols of comparable molecular masses?
(ii) Why do primary amines have higher boiling point than tertiary amines?
(iii) Why are aliphatic amines stronger bases than aromatic amines.?
Answer:
(i) Amines lose a proton to form amide ion. Alcohols lose a proton to form alkoxide ion.
RNH2 à RNH- + H+
R−OH à R−O- + H+
O is more electronegative than N, the negative charge is more easily accommodated in RO- than in R−NH-. Hence, amines are less acidic than alcohols of comparable molecular masses.
(ii) In primary amines, N atoms have two H atoms which results in extensive intermolecular H bonding. In tertiary amines, N atoms do not have H atoms and hydrogen bonding is not possible. Hence, primary amines have higher boiling point than tertiary amines.
(iii) Aliphatic amines stronger bases than aromatic amines due to following reasons:
(a) Aromatic amines have resonance due to which lone pair of electrons on N atom is delocalized over benzene ring and is less available for protonation.
(b) The stability of aryl amine ions is lower than the stability of alkyl amines. Protonation of aromatic amines is not favoured.
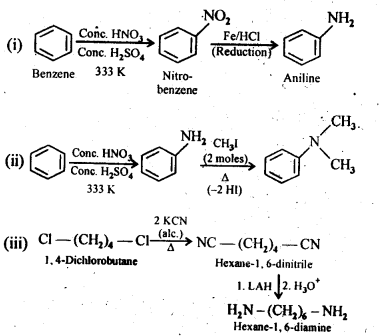
Q) How will you convert:
(i) Benzene into aniline
(ii) Benzene into N,N-dimethylaniline
(iii) Cl-(CH2)4-Cl into Hexane -1,6- diamine
Answer:
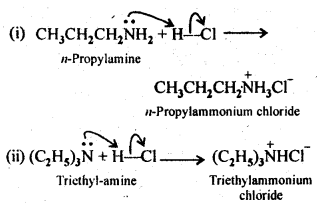
Q) Complete the following acid-base reactions and name the products:
(i) CH3CH2CH2NH2+HCl ——–>
(ii) (C2H5)3 N+HCl ——–>
Answer:
Q) Write chemical reaction of aniline with benzoyl chloride and write the name of the product obtained.
Ans:
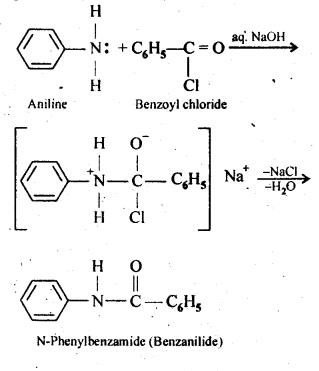
Answer:
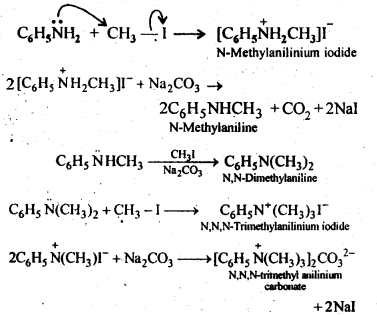
Q) Write structures of different isomers corresponding to the molecular formula, C3H9N. Write IUPAC names of the isomers which will liberated N2 gas on treatment with nitrons acid.
Answer: In ‘all, four structural isomers are possible. These are:
Q) Convert:
(i) 3-Methylanilineinto3-nitrotoluene
(ii) Aniline into 1,3,5- Tribromo benzene
Answer:
Answer: (i) Propan-2-amine(1°)
(ii) Propan-1-amine (1°),
(iii) N-Methylpropan-2-amine (2°).
(iv) 2-Methylpropan-2-amine(l°)
(v) N-MethylbenzenamineorN-methylaniline(2°)
(vi) N-Ethyl-N-methylethanamine (3°)
(vii) 3-Bromobenzenamine or 3-bromoaniline (1°)
Q) Give one chemical test to distinguish between the following pairs of compounds:
(i)Methylamine and dimethylamine
(ii) Secondary and tertiary amines
(iii) Ethylamine and aniline
(iv) Aniline and benzylamine
(v) Aniline and N-Methylaniline.
Ans:

Answer: The distinction in the three types of amines can be done by the following methods :
(i) Hinsberg’s Test:
This is a very useful test for the distinction of primary, secondary and tertiary amines. An amine is shaken with Hinsberg’s reagent (benzene suiphonyl chloride) in the presence of excess of aqueous KOH solution. The reactions taking place are given below.
- A primary amine forms N – alkyl benzene suiphonamide which dissolves in aqueous KOH solution to form potassium salt and upon acidification with dilute HCI regenerates the insoluble suiphonamide.
- A secondary amine forms N, N – dialkylbenzene suiphonamide which remains insoluble in aqueous KOH and even after acidification with dilute HCl
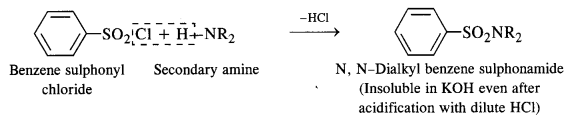
- A tertiary amine does not react with benzene suiphonyl chloride and remains insoluble in aqueous KOH. However, on acidification with dilute HCI it gives a clear solution due to the formation of the ammonium salt.
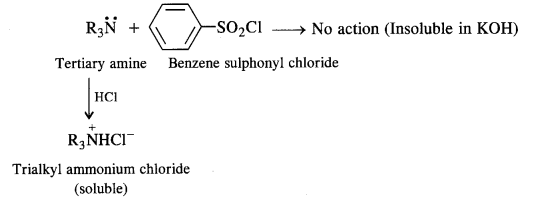
(ii) Reaction with nitrous acid:
All the three types of amines, aliphatic as well as aromatic, react with nitrous acid under different conditions to form variety of products. Since nitrous acid is highly unstable, it is prepared in situ by the action of dilute hydrochloric acid on sodium nitrite.
(a) Primary aliphatic amines react with nitrous acid at low temperature (cold conditions) to form primary alcohol and nitrogen gas accompanied by brisk effervescence. Nitrous acid is unstable in nature and is prepared in situ by reacting sodium nitrite with dilute hydrochloric acid. For example,
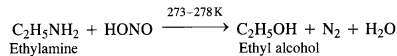
The reaction is used as a tesijôr primary aliphadc amines as no other amine evolves nitrogen with nurous acid.
(b) Primary aromatic amines such as aniline react with nitrous acid under ice cold conditions (273 – 278 K) to form benzen diazonium salt. The reaction is known as diazotisation reaction.
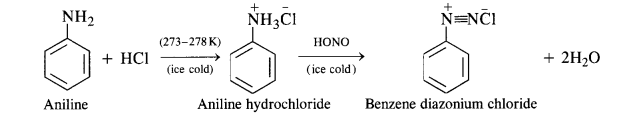
in case, the temperature is allowed to rise above 278 K, benzene diazortium chloride is decomposed by water to form phenol.
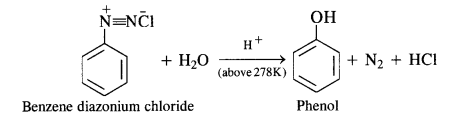
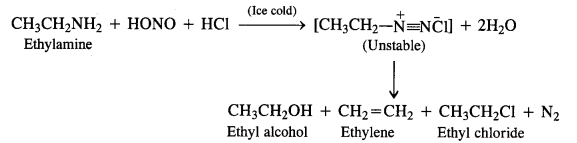
Aliphatic primary amines also react with nitrous acid to form alkyl diazonium salts in a similar manner. But these are
quite unstable and decompose to form a mixture of alcohols, alkenes and alkyl halides along with the evolution of N2 gas.
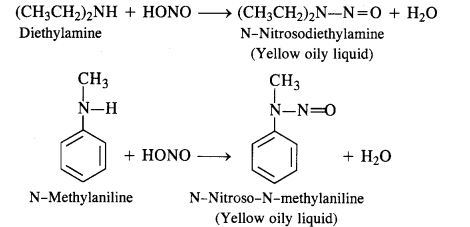
(c) Secondary amines (both aliphatic and aromatic) react with nitrous acid to form nitrosoamines which separate as Yellow oily liquids.
(d) Tertiary aliphatic amines dissolve in a cold solution of nitrous acid to form salts which decompose on warming to give nitrosoamine and alcohol. For example,
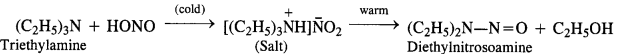
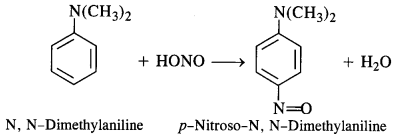
(e) Tertiary aromatic amines react with nitrous acid to give a coloured nitrosoderivative. This reaction is called nitrosation and as a result, a hydrogen atom in the para position gets replaced by a nitroso (-NO) group. For example,











 NCERT Solutions for Class 12 Chemistry C...
NCERT Solutions for Class 12 Chemistry C...
 Class 12 Chemistry Chapter 9 NCERT Solut...
Class 12 Chemistry Chapter 9 NCERT Solut...
 Class 12 Chemistry Chapter 8 NCERT Solut...
Class 12 Chemistry Chapter 8 NCERT Solut...

