Table of Contents
পর্যায় সারণী
পর্যায় সারণী: পর্যায় সারণী হল একটি সারণী প্রদর্শন যেখানে সমস্ত উপাদানকে তাদের রাসায়নিক বৈশিষ্ট্য অনুযায়ী সাজানো আছে। এটি পারমাণবিক সংখ্যা দ্বারা সংগঠিত রাসায়নিক উপাদানগুলির একটি সারণী বিন্যাস। আধুনিক পর্যায় সারণীতে 18টি গ্রুপ এবং 7টি পর্যায় রয়েছে। মেন্ডেলিভ তাদের পারমাণবিক সংখ্যা অনুসারে পরমাণুর কনফিগারেশন শুরু করেছিলেন। এই আর্টিকেলটি থেকে, প্রার্থীরা বাংলায় পর্যায় সারণির উপাদানগুলির তালিকা এবং তাদের বৈশিষ্ট্যগুলি, মেন্ডেলিভের পর্যায় সারণী, নিউল্যান্ডসের অক্টেভের আইন, পর্যায় সারণীর উদ্ভাবক ইত্যাদি সম্পর্কে পড়ুন।
পর্যায় সারণী: ইতিহাস
পর্যায় সারণির ইতিহাস হল উপাদানগুলির রাসায়নিক এবং ভৌত বৈশিষ্ট্য বোঝার ক্ষেত্রে দুই শতাব্দীর বিকাশের প্রতিফলন। অঁতোয়ান লাভোয়াজিয়ে, ইয়োহান ভোলফগাং ডোবেরেইনার, জন নিউল্যান্ড, ইউলিয়ুস লোটার মাইয়ার, গ্লেন থিওডোর সিবোর্গ এবং আরও কিছু রসায়নবিদের পর্যায় সারণিতে অবদান রয়েছে।
2012 সাল পর্যন্ত সর্বমোট 118টি মৌল শনাক্ত হয়েছে। গোড়ার দিকে বিজ্ঞানীরা মৌলগুলোকে ধাতু এবং অধাতু এই দুই ভাগে ভাগ করেছিলেন। কিন্তু এই বিভাজন খুব বেশি ফলপ্রসূ হয়নি কারণ ধাতব ও অধাতব মৌলের ধর্মের প্রভেদ খুব স্পষ্ট নয়। ডাল্টনের পরমাণুতত্ত্ব প্রকাশিত হওয়ার পর মৌলগুলির পারমাণবিক ভরের সঙ্গে তাদের ধর্মের সম্পর্ক স্থাপনের প্রচেষ্টা শুরু করা হয়। কিন্তু যতদিন পর্যন্ত সঠিক পারমাণবিক ভর নির্ণয়ের পদ্ধতি আবিষ্কৃত না হয়েছিল ততদিন পর্যন্ত মৌলের স্বাভাবিক শ্রেণিবিন্যাসের কাজ বেশি দূর অগ্রসর হতে পারেনি। মৌলসমূহের সঠিক পারমাণবিক ভর নির্ণীত হওয়ার পরেই মৌলসমূহের পারমাণবিক গুরুত্ব ও তাদের ধর্মের সমন্বয় সাধন করে মৌলগুলোর শ্রেণিবিন্যাসের প্রচেষ্টা বিশেষ গুরুত্ব লাভ করে। যা থেকে আধুনিক পর্যায় সারণির সৃষ্টি হয়।
পর্যায় সারণী উপাদানগুলির তালিকা
নিচে একটি ছবির মাধ্যমে পর্যায় সারণীর উপাদান গুলি প্রদর্শন করা হয়েছে |
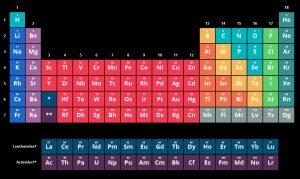
গ্রুপ 1 (ক্ষার ধাতু)
ক্ষার ধাতুগুলি পর্যায় সারণির গ্রুপ 1-এর মৌলগুলির সিরিজ। সিরিজটি লিথিয়াম (Li), সোডিয়াম (Na), পটাসিয়াম (K), রুবিডিয়াম (Rb), সিজিয়াম (Cs), এবং ফ্র্যান্সিয়াম (Fr) উপাদান নিয়ে গঠিত।
(বৈশিষ্ট্য)
- ক্ষারীয় ধাতুগুলি রূপালী রঙের (সিজিয়ামের একটি সোনালি আভা আছে), নরম, কম ঘনত্বের ধাতু।
- এই সমস্ত উপাদানগুলির একটি ভ্যালেন্স ইলেকট্রন রয়েছে যা একটি একক ধনাত্মক চার্জ সহ একটি আয়ন গঠন করে।
- তাদের নিজ নিজ ক্ষেত্রে সর্বনিম্ন আয়নীকরণ শক্তি রয়েছে। এটি তাদের খুব প্রতিক্রিয়াশীল করে তোলে এবং তারা সবচেয়ে সক্রিয় ধাতু।
- তাদের সক্রিয়তার কারণে, তারা প্রাকৃতিকভাবে আয়নিক যৌগগুলিতে থাকে, তাদের মৌলিক অবস্থায় নয়।
- ক্ষারীয় ধাতুগুলি হ্যালোজেনের সাথে সহজে বিক্রিয়া করে আয়নিক লবণ তৈরি করে, যেমন টেবিল লবণ, সোডিয়াম ক্লোরাইড (NaCl)।
- তারা হাইড্রোজেন গ্যাস মুক্ত করতে জলের সাথে বিক্রিয়া করে।
ক্ষার ধাতু + জল → ক্ষার ধাতু হাইড্রোক্সাইড + হাইড্রোজেন
গ্রুপ 2 (ক্ষারীয় মৃত্তিকা ধাতু)
পর্যায় সারণির গ্রুপ 2 সিরিজটিতে বেরিলিয়াম (Be), ম্যাগনেসিয়াম (Mg), ক্যালসিয়াম (Ca), স্ট্রন্টিয়াম (Sr), বেরিয়াম (Ba) এবং রেডিয়াম (Ra) উপাদান রয়েছে।
পর্যায় সারণি গ্রুপ 2- মৌলের বৈশিষ্ট্য
- ক্ষারীয় মৃত্তিকা ধাতুগুলি রূপালী রঙের, নরম, কম ঘনত্বের ধাতু, যদিও ক্ষারীয় ধাতুগুলির চেয়ে কিছুটা শক্ত।
• এই সমস্ত মৌলের দুটি ভ্যালেন্স ইলেকট্রন রয়েছে এবং দুটি-প্লাস চার্জের সাথে আয়ন গঠন করে - বেরিলিয়াম হল গ্রুপের সবচেয়ে কম ধাতব মৌল এবং এর যৌগগুলিতে সমযোজী বন্ধন তৈরি করে।
- তারা আয়নিক লবণ তৈরি করতে হ্যালোজেনের সাথে সহজেই বিক্রিয়া করে এবং জলের সাথে ধীরে ধীরে বিক্রিয়া করতে পারে।
গ্রুপ 13 (বোরন গ্রুপ)
পর্যায় সারণির গ্রুপ 13 বোরন (B), অ্যালুমিনিয়াম (Al), গ্যালিয়াম (Ga), ইন্ডিয়াম (In), থ্যালিয়াম (Tl) উপাদান নিয়ে গঠিত।
পর্যায় সারণির 13 গ্রুপের মৌলের বৈশিষ্ট্য
- এই গ্রুপে, আমরা অধাতু চরিত্রের দিকে পরিবর্তন দেখতে শুরু করি। প্রথমে গ্রুপের শীর্ষে উপস্থিত, বোরন হল একটি ধাতব পদার্থ, এতে ধাতু এবং অধাতুর মধ্যে অন্তর্বর্তী বৈশিষ্ট্য রয়েছে এবং গ্রুপের বাকি অংশগুলি ধাতু।
- এই গ্রুপের মৌলের তিনটি ভ্যালেন্স ইলেকট্রন থাকার দ্বারা চিহ্নিত করা হয়। আয়নিক যৌগগুলিতে তিন প্লাস চার্জ সহ আয়ন গঠন করতে ধাতুগুলি তিনটি ইলেকট্রন হারাতে পারে।
- অ্যালুমিনিয়াম পৃথিবীর ভূত্বকের তৃতীয় সর্বাধিক প্রাপ্ত উপাদান (7.4 শতাংশ), এবং প্যাকেজিং উপকরণগুলিতে ব্যাপকভাবে ব্যবহৃত হয়। অ্যালুমিনিয়াম একটি সক্রিয় ধাতু, তবে স্থিতিশীল অক্সাইড ধাতুর উপর একটি প্রতিরক্ষামূলক আবরণ তৈরি করে যা এটিকে ক্ষয় প্রতিরোধী করে তোলে।
গ্রুপ 14 (কার্বন গ্রুপ)
পর্যায় সারণির গ্রুপ 14-এ কার্বন (C), সিলিকন (Si), জার্মেনিয়াম (Ge), টিন (Sn), এবং সীসা (Pb) মৌল রয়েছে।
পর্যায় সারণীর গ্রুপ 14 মৌলের বৈশিষ্ট্য
- এই গোষ্ঠীতে অধাতু কার্বন, দুটি মেটালয়েড এবং দুটি ধাতুর সাথে একটি মিশ্র ধরণের মৌল রয়েছে। সাধারণ বৈশিষ্ট্য হল চারটি ভ্যালেন্স ইলেকট্রন।
- দুটি ধাতু, টিন এবং সীসা, অপ্রতিক্রিয়াশীল ধাতু এবং উভয়ই আয়নিক যৌগগুলিতে দুই বা চার- ধনাত্মক চার্জ সহ আয়ন গঠন করতে পারে।
- কার্বন যৌগিক আয়ন গঠনের পরিবর্তে চারটি সমযোজী বন্ধন গঠন করে। মৌলিক অবস্থায়, এর বিভিন্ন রূপ রয়েছে, যার মধ্যে সর্বাধিক পরিচিত গ্রাফাইট এবং হীরা।
- কিছু ক্ষেত্রে সিলিকন কার্বনের অনুরূপ, এটি চারটি সমযোজী বন্ধন গঠন করে, কিন্তু এটি বড় যৌগ গঠন করে না। সিলিকন হল পৃথিবীর ভূত্বকের দ্বিতীয় সর্বাধিক প্রাপ্ত উপাদান (25.7 শতাংশ) এবং আমরা সিলিকন-ধারণকারী উপকরণ দ্বারা বেষ্টিত:যেমন ইট, মৃৎপাত্র, চীনামাটির বাসন, লুব্রিকেন্ট, সিল্যান্ট, কম্পিউটার চিপস এবং সৌর কোষ।
- সহজতম অক্সাইড, সিলিকন ডাই অক্সাইড (SiO2) বা সিলিকা, অনেক শিলা এবং খনিজ পদার্থের একটি উপাদান।
গ্রুপ 15 (নাইট্রোজেন গ্রুপ)
নাইট্রোজেন গ্রুপ হল পর্যায় সারণির গ্রুপ 15 (পূর্বে গ্রুপ V) এর মৌলগুলির সিরিজ। এটি নাইট্রোজেন (N), ফসফরাস (P), আর্সেনিক (As), অ্যান্টিমনি (Sb) এবং বিসমাথ (Bi) নিয়ে গঠিত।
পর্যায় সারণির গ্রুপ 15 মৌলের বৈশিষ্ট্য
- এই উপাদানগুলির সবকটিতেই পাঁচটি ভ্যালেন্স ইলেকট্রন রয়েছে। নাইট্রোজেন এবং ফসফরাস অধাতু। নাইট্রাইড এবং ফসফাইড আয়ন গঠনের জন্য তিনটি ঋণাত্মক চার্জ, তিনটি ইলেকট্রন গ্রহণ করতে পারে।
- নাইট্রোজেন, ডায়াটমিক অণু হিসাবে বায়ুর প্রধান উপাদান এবং উভয় উপাদানই জীবনের জন্য অপরিহার্য। নাইট্রোজেন মানবদেহের ওজনের প্রায় 3 শতাংশ এবং ফসফরাস প্রায় 1.2 শতাংশ। বাণিজ্যিকভাবে, এই মৌলগুলি সারের জন্য গুরুত্বপূর্ণ। আর্সেনিক এবং অ্যান্টিমনি হল মেটালয়েড এবং বিসমাথ গ্রুপের একমাত্র ধাতু। বিসমাথ তিনটি ইলেকট্রন হারিয়ে তিন প্লাস চার্জ সহ একটি আয়ন তৈরি করতে পারে।
- বিসমাথ হল সবচেয়ে ভারী সম্পূর্ণ স্থিতিশীল মৌল যা তেজস্ক্রিয়ভাবে অন্যান্য সরল উপাদানে ক্ষয় হয় না।
গ্রুপ 16 (চ্যালকোজেন)
সেগুলি হল অক্সিজেন (O), সালফার (S), সেলেনিয়াম (Se), টেলুরিয়াম (Te), তেজস্ক্রিয় পোলোনিয়াম (Po), এবং সিন্থেটিক আনআনহেক্সিয়াম (Uuh)।
পর্যায় সারণীর গ্রুপ 16 মৌলের বৈশিষ্ট্য
- এই গ্রুপে মৌলের ছয়টি ভ্যালেন্স ইলেকট্রন রয়েছে। অক্সিজেন এবং সালফার অধাতু; তাদের মৌলিক রূপটি আণবিক, এবং তারা দুটি ঋণাত্মক চার্জ সহ আয়ন গঠনের জন্য দুটি ইলেকট্রন অর্জন করতে পারে।
- সালফারে সম্ভবত যেকোনো উপাদানের মধ্যে সবচেয়ে বেশি অ্যালোট্রোপ রয়েছে, যদিও সবচেয়ে সাধারণ এবং স্থিতিশীল রূপ হল S8 অণুর হলুদ কেলাস।
গ্রুপ 17 (হ্যালোজেন)
হ্যালোজেন হল পর্যায় সারণির গ্রুপ 17 (পূর্বে গ্রুপ VII বা VIIa)। এতে আছে ফ্লোরিন (F), ক্লোরিন (Cl), ব্রোমিন (Br), আয়োডিন (I), অ্যাস্টাটাইন (At)।
পর্যায় সারণীর গ্রুপ 17 মৌলের বৈশিষ্ট্য
- এই সব মৌলের সাতটি ভ্যালেন্স ইলেকট্রন আছে।
- এই গ্রুপটিই প্রথম যেটি সম্পূর্ণরূপে অধাতু নিয়ে গঠিত।
- তারা তাদের প্রাকৃতিক অবস্থায় ডায়াটমিক অণু হিসাবে বিদ্যমান
- ফ্লোরিন এবং ক্লোরিন ঘরের তাপমাত্রায় গ্যাস হিসেবে, তরল হিসেবে ব্রোমিন এবং কঠিন হিসেবে আয়োডিন বিদ্যমান।
- তাদের বাইরের ইলেকট্রন শেলগুলি পূরণ করতে তাদের আরও একটি ইলেকট্রনের প্রয়োজন, এবং তাই একক চার্জযুক্ত ঋণাত্মক আয়ন গঠনের জন্য একটি ইলেকট্রন অর্জন করার প্রবণতা রয়েছে। এই ঋণাত্মক আয়নগুলিকে হ্যালাইড আয়ন হিসাবে উল্লেখ করা হয় এবং এই আয়নগুলি ধারণকারী লবণগুলি হ্যালাইড হিসাবে পরিচিত।
- হ্যালোজেন অত্যন্ত সক্রিয়, এবং যথেষ্ট পরিমাণে জৈবিক জীবের জন্য ক্ষতিকারক বা প্রাণঘাতী হতে পারে।
- ফ্লোরিন হল সবচেয়ে বেশি প্রতিক্রিয়াশীল এবং গ্রুপের নিচে যাওয়ার সাথে সাথে সক্রিয়তা হ্রাস পায়।
- ক্লোরিন এবং আয়োডিন উভয়ই জীবাণুনাশক হিসাবে ব্যবহৃত হয়।
- তাদের মৌলিক অবস্থায়, হ্যালোজেনগুলি অক্সিডাইজিং এজেন্ট এবং ব্লিচ করতে ব্যবহৃত হয়।
- ক্লোরিন হল বেশিরভাগ ফ্যাব্রিক ব্লিচের সক্রিয় উপাদান এবং বেশিরভাগ কাগজের পণ্য উৎপাদনে ব্যবহৃত হয়।
গ্রুপ 18 (নোবেল গ্যাস)
নোবেল গ্যাসগুলি পর্যায় সারণির গ্রুপ 18 ( গ্রুপ VIII) তে রয়েছে। এগুলি হল হিলিয়াম, নিয়ন, আর্গন, ক্রিপ্টন, জেনন এবং রেডন। এগুলিকে কখনও কখনও নিষ্ক্রিয় গ্যাস বা বিরল গ্যাস বলা হয়।
পর্যায় সারণীর গ্রুপ 18 মৌলের বৈশিষ্ট্য
- নোবেল গ্যাসগুলি সমস্ত অ-ধাতু এবং সম্পূর্ণরূপে পূর্ন ইলেকট্রনের শেল দ্বারা চিহ্নিত করা হয়।
- ভৌতভাবে এগুলি ঘরের তাপমাত্রায় মনোঅ্যাটমিক গ্যাস হিসেবে বিদ্যমান, এমনকি বৃহত্তর পারমাণবিক ভরের ক্ষেত্রেও। এর কারণ হল তাদের আকর্ষণের খুব দুর্বল আন্তঃ-পারমাণবিক শক্তি, এবং ফলস্বরূপ খুব কম গলনাঙ্ক এবং স্ফুটনাঙ্ক।
- ক্রিপ্টন এবং জেনন হল একমাত্র নোবেল গ্যাস যা কোনো যৌগ গঠন করে। এই উপাদানগুলি এটি করতে পারে কারণ তারা একটি খালি d সাবশেলে ইলেকট্রন গ্রহণ করে একটি প্রসারিত অক্টেট গঠন করার সম্ভাবনা থাকে।
পর্যায় সারণী: নিউল্যান্ডের অক্টেভ সূত্র
রসায়নে অষ্টক সূত্র ইংরেজ রসায়নবিদ নিউল্যান্ড দ্বারা তৈরি একটি সূত্র। 1865 সালে নিউল্যান্ড বলেন যে, যদি রাসায়নিক মৌলগুলো ক্রমবর্ধমান পারমাণবিক ভর অনুসারে সাজানো হয়, তবে একই রকম ভৌত ও রাসায়নিক বৈশিষ্ট্যের সাথে সপ্তম মৌলের ভৌত ও রাসায়নিক বৈশিষ্ট্য মিলে যায়। 1864 সালে, নিউল্যান্ডস উপাদানগুলিকে শ্রেণিবদ্ধ করার চেষ্টা করেছিল। সঙ্গীতে সাতটি মিউজিক্যাল নোট আছে। প্রতিটি অষ্টম নোট প্রথমটির মতো এবং এটি পরবর্তী স্কেলের প্রথম নোট। একইভাবে, নিউল্যান্ড বলেছেন যে একটি মৌল থেকে শুরু হওয়া অষ্টম মৌল সঙ্গীতের অষ্টম নোটের মতো প্রথমটির পুনরাবৃত্তি। তাই তিনি এই সম্পর্ককে অষ্টক সূত্র বলে অভিহিত করেছেন।
- নিউল্যান্ডের টেবিলে লিথিয়াম, সোডিয়াম এবং পটাসিয়াম একে অপরের কাছাকাছি স্থান দখল করে।
- ফ্লোরিন এবং ক্লোরিন বা অক্সিজেন এবং সালফার একে অপরের কাছাকাছি স্থাপন করা হয়েছিল।
- দ্রষ্টব্য: এই শ্রেণিবিন্যাস ছোট পারমাণবিক ভরের উপাদানগুলির সাথে ভাল কাজ করেছিল কিন্তু বড় পারমাণবিক ভরের উপাদানগুলির ক্ষেত্রে ব্যর্থ হয়েছে।
মেন্ডেলিভের পর্যায় সারণী
মেন্ডেলিভের পর্যায় সারণী সম্বন্ধে নিচে বিস্তারিতভাবে আলোচনা করা হয়েছে |
- মেন্ডেলিভ 1869 সালে নিজের তত্ব প্রকাশ করেন। তিনি বলেন, পারমাণবিক ভর ব্যবহার করে উপাদানগুলিকে সাজানোর মাধ্যমে, তার সময়ে উপস্থিত মৌলগুলোর বৈশিষ্ট্য নির্ভুলতার সাথে নির্ণয় করা যায়।
- পারমাণবিক সংখ্যা একটি উপাদানের নিখুঁত সংজ্ঞা এবং পর্যায় সারণীর ক্রমানুসারে একটি বাস্তব ভিত্তি প্রদান করে।
- মেন্ডেলিভ বুঝতে পেরেছিলেন যে উপাদানগুলির ভৌত এবং রাসায়নিক বৈশিষ্ট্যগুলি একটি ‘পর্যায়ক্রমিক’ উপায়ে তাদের পারমাণবিক ভরের সাথে সম্পর্কিত, এবং সেগুলিকে এমনভাবে সাজিয়েছিলেন যাতে অনুরূপ বৈশিষ্ট্যযুক্ত উপাদানগুলির দলগুলি তার টেবিলের উল্লম্ব কলামে পড়ে। আধুনিক যুগের পর্যায় সারণী মেন্ডেলিভের প্রাথমিক 63টি উপাদানের বাইরে প্রসারিত হয়।
আধুনিক পর্যায় সারণী
আধুনিক পর্যায় সারণীর বৈশিষ্ট্যগুলি হল নিম্নরূপ –
1)VALENCY (ভ্যালেন্সি): ভ্যালেন্সিকে “স্থিতিশীল কনফিগারেশন (অর্থাৎ ভ্যালেন্স শেলে 8টি ইলেকট্রন, কিছু বিশেষ ক্ষেত্রে এটি 2টি ইলেকট্রন)” অর্জন করার জন্য “অন্যান্য উপাদানের পরমাণুর সাথে কোনো একটি মৌলের পরমাণুর সমন্বয় ক্ষমতা হিসাবে সংজ্ঞায়িত করা যেতে পারে।”
2) ATOMIC SIZE (পারমাণবিক আকার): এটি একটি বিচ্ছিন্ন পরমাণুর নিউক্লিয়াসের কেন্দ্র থেকে এর বাইরেরতম ইলেকট্রন ধারণকারী শেল দূরত্বকে নির্দেশ করে।
বাম থেকে ডানে সরে গেলে পারমাণবিক ব্যাসার্ধ হ্রাস পায়। এটি পারমাণবিক চার্জ বৃদ্ধির কারণে হয় যা ইলেকট্রনকে নিউক্লিয়াসের কাছাকাছি টানতে থাকে এবং পরমাণুর আকার হ্রাস করে।
একটি গ্রুপে, অনেকগুলি শেল বৃদ্ধির কারণে পারমাণবিক আকার উপরে থেকে নীচে বৃদ্ধি পায়।
3) METALLIC AND NON-METALLIC PROPERTIES (ধাতব এবং অধাতব বৈশিষ্ট্য):
- বাম থেকে ডানে ধাতব চরিত্র হ্রাস পায় এবং অধাতু চরিত্র বৃদ্ধি পায়।
- একটি গ্রুপে ধাতব চরিত্র উপর থেকে নীচে বৃদ্ধি পায় যখন অধাতু চরিত্র হ্রাস পায়।
4) ELECTRONEGATIVITY (ইলেক্ট্রোনেগেটিভিটি): সমযোজী বন্ধন আবদ্ধ, বন্ধনের ইলেকট্রন জোড়কে কোনো পরমাণুর ক্ষেত্রে নিজের দিকে আকর্ষণ করার আপেক্ষিক প্রবণতাকে তড়িৎ ঋণাত্মকতা বলে। বাম থেকে ডানে, তড়িৎ ঋণাত্মকতার মান বৃদ্ধি পায় এবং উপর থেকে নীচের দিকে তড়িৎ ঋণাত্মকতার মান হ্রাস পায়।
5) IONIZATION ENERGY (আয়োনাইজেশন এনার্জি): আয়নীকরণ শক্তি (IE) হল একটি বিচ্ছিন্ন বায়বীয় পরমাণুর সবচেয়ে শিথিলভাবে আবদ্ধ ভ্যালেন্স ইলেকট্রনকে, অপসারণের জন্য প্রয়োজনীয় শক্তির পরিমাণ।
বাম থেকে ডানে আয়নীকরণ শক্তির মান বৃদ্ধি পায় এবং উপরে থেকে নীচে আয়নীকরণ শক্তির মান হ্রাস পায়।
6) ELECTRON AFFINITY (ইলেক্ট্রন অ্যাফিনিটি): একটি পরমাণু বা অণুর ইলেক্ট্রন অ্যাফিনিটি হল, যখন একটি ইলেকট্রন বায়বীয় অবস্থায় একটি নিরপেক্ষ পরমাণু বা অণুতে একটি ঋণাত্মক আয়ন গঠনের জন্য যোগ করা হয় তখন নির্গত বা প্রদত্ত করা শক্তির পরিমাণ।
বাম থেকে ডানে ইলেকট্রন অ্যাফিনিটির মান বৃদ্ধি পায় এবং গ্রুপে উপরে থেকে নীচের দিকে ইলেক্ট্রনের অ্যাফিনিটির মান হ্রাস পায়।
| Also Check | |
| ADDA247 Bengali Homepage | Click Here |
| ADDA247 Bengali Study Material | Click Here |
Adda247 ইউটিউব চ্যানেল – Adda247 YouTube Channel
Adda247 টেলিগ্রাম চ্যানেল – Adda247 Telegram Channel